Ruim tien jaar geleden hebben we in een gezaghebbend tijdschrift (1) een voorspelling gedaan over het maken van ingewikkelde moleculen, vooral medicijnen. Wij voorzagen de integratie van chemo- en biokatalyse in een reactor die tegelijkertijd katalysator zou zijn. Een zeer efficiënt systeem en een droom voor de geneesmiddelenindustrie: de computer zou het syntheseschema maken, en dit zou worden uitgevoerd door robots in een groot aantal geschakelde katalytische minireactoren. Maar de industriële praktijk blijkt een slagje anders. De moleculaire structuren van moderne medicijnen zijn dermate ingewikkeld geworden dat ook de modernste chemie er niet goed vat op kan krijgen. In de fabrieken leidt dit tot inefficiënte chemische processen met heel veel afval. De klok terug! Maar met meer (semi-)natuurlijke geneesmiddelen en met hulp van de synthetische biologie zou toch een efficiënte en duurzame geneesmiddelenproductie waargemaakt kunnen worden.
Een elegant systeem
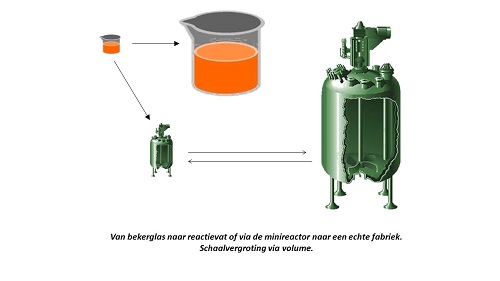
Wij hadden een elegant systeem voor ogen, waarin ontwerp en productie van medicijnen ineengeschoven zouden zijn. Nieuwe medicijnen (of de ‘lead moleculen’ waaruit zij gemaakt worden) zouden in de toekomst volledig geautomatiseerd gemaakt kunnen worden; en in voldoende hoeveelheden om enkele allereerste testen op mogelijke werking te kunnen uitvoeren. Een belangrijk voordeel zou het vermijden van problemen met opschaling zijn. In de chemische industrie is de stap van lab naar fabriek meestal groot, leidend tot veel hoofdbrekens en tussentijdse mislukkingen. In ons systeem zou de bereidingswijze voor kleine hoeveelheden representatief kunnen zijn voor productie op grotere schaal. Het geheel zou bestaan uit een serie slim geschakelde reactoren met in elke reactor de katalysator voor de gewenste omzetting, in het lab op miniatuurschaal, tot het niveau van processen op een chip. Dit zou uitvoering voor testhoeveelheden en voor latere commerciële hoeveelheden dicht bij elkaar brengen, simpelweg door een heleboel katalytische reactorchips naast elkaar te zetten.
 Katalyse als sleutel voor duurzame geneesmiddelenproductie
Katalyse als sleutel voor duurzame geneesmiddelenproductie
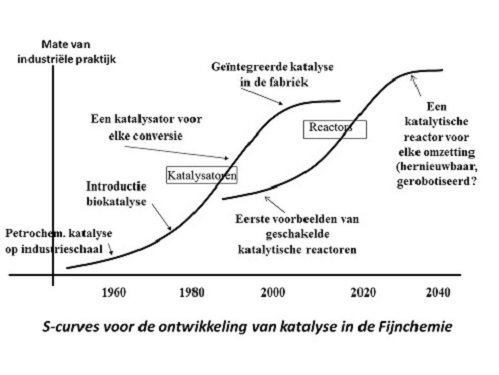
Katalyse speelt al lang een sleutelrol in de petrochemie, waar relatief eenvoudige moleculen worden gesynthetiseerd. De komst van de biokatalyse met behulp van enzymen zo’n 30 jaar geleden, maakte het gebruik van katalyse voor meer ingewikkelde producten zoals voedingsadditieven, vitamines en medicijnen mogelijk. Voor elk proces hebben we nu tenminste één, vaak ook meer katalysatoren ter beschikking. Met steeds meer succes worden processen achter elkaar geschakeld, elk met hun eigen katalysator. Dat is het lijntje van de linker S-curve. In de industriële praktijk kunnen we effecten hiervan vooral vinden in de fijnchemie, de industrietak die onder meer medicijnen maakt. Voor grote bestaande geneesmiddelen als antibiotica en cardiovasculaire medicijnen zijn de fabrieksprocessen sterk geoptimaliseerd. Zowel biokatalyse als chemokatalyse is alom aanwezig en de hoeveelheid afval per kilo medicijn (een veel gebruikte ruwe graadmeter voor doelmatigheid) is van tientallen naar enkele kilo’s teruggebracht. Bovendien is het afval vaak veel minder milieubelastend en zijn er steeds betere mogelijkheden voor hergebruik. De eerste opstapjes naar integratie van katalysator en reactor hebben de industrie bereikt, in de vorm van enzymen die aan materialen zijn vastgemaakt (geïmmobiliseerd) in aangepaste reactoren. In de petrochemie zijn reactor en katalysator al tientallen jaren geheel op elkaar afgestemd. Alles leek er op dat de fijnchemie deze weg ook zou gaan volgen. De overstap op de tweede S-curve (discontinuïteit) lag dus voor de hand: de fijnchemie ging de petrochemie volgen.
De discontinuïteit, maar dan anders
In de wetenschappelijke literatuur is heel veel te vinden over de voorspelde integratie van katalysator en reactor. In microreactoren kunnen we vier of vijf synthesestappen achter elkaar uitvoeren. Wij kunnen meerdere katalytische reactoren op een chip zetten, prachtige technologie. Geschakelde biokatalyse door absorptie van meerdere enzymen op een oppervlak is ook heel goed mogelijk. Maar intussen gaat de farmaceutische industrie een andere weg. Wij kunnen dat aflezen uit de productie van afval per kilo eindproduct: bij de nieuwste medicijnen neemt deze niet verder af, maar juist sterk toe, tot soms meer dan een ton afval per kilo eindproduct.
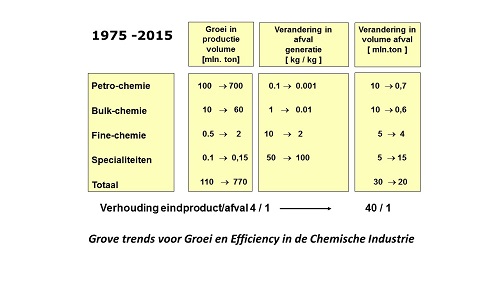 Wat wij niet hadden voorzien was de zeer snelle toename van de moleculaire complexiteit van nieuwe medicijnen. Deze wordt veroorzaakt door de mogelijkheid, grote bibliotheken van kandidaat-moleculen voor nieuwe medicijnen geautomatiseerd te genereren. Daarna volgt een immense tijdsdruk om een nieuw medicijn zo snel mogelijk te ontwikkelen. Zodra de computer uit die bibliotheken enkele kandidaten met mogelijke geneeskrachtige werking aanwijst, wil de industrie die moleculen ook direct in handen hebben voor de eerste testen. De chemici in het lab grijpen terug op ouderwetse, bekende methodes en nemen (krijgen) niet de tijd om na te denken over mogelijk efficiëntere katalytische processen, laat staan over bijpassende reactoren. ‘Dat komt later wel als onze stof inderdaad een succesvol medicijn wordt.’ Want er zijn altijd veel meer mislukkingen dan successen.
Wat wij niet hadden voorzien was de zeer snelle toename van de moleculaire complexiteit van nieuwe medicijnen. Deze wordt veroorzaakt door de mogelijkheid, grote bibliotheken van kandidaat-moleculen voor nieuwe medicijnen geautomatiseerd te genereren. Daarna volgt een immense tijdsdruk om een nieuw medicijn zo snel mogelijk te ontwikkelen. Zodra de computer uit die bibliotheken enkele kandidaten met mogelijke geneeskrachtige werking aanwijst, wil de industrie die moleculen ook direct in handen hebben voor de eerste testen. De chemici in het lab grijpen terug op ouderwetse, bekende methodes en nemen (krijgen) niet de tijd om na te denken over mogelijk efficiëntere katalytische processen, laat staan over bijpassende reactoren. ‘Dat komt later wel als onze stof inderdaad een succesvol medicijn wordt.’ Want er zijn altijd veel meer mislukkingen dan successen.
Helaas, die tijd komt er niet. Als de eerste testen veelbelovend zijn wil de industrie zo snel mogelijk meer materiaal, van dezelfde kwaliteit. Die eerste, omslachtige route maar herhalen dus. En dat gaat zo door tot de commerciële fabriek er staat. Daar komt bij dat de nieuwste geneesmiddelen zó complex zijn dat het zelfs met de modernste chemie niet zou lukken, daarvoor snel genoeg een slimme reeks van enkele tientallen katalysatoren en reactors te ontwikkelen. De chemici en procestechnologen komen aan moderne katalyse niet toe en nemen hun toevlucht tot ouderwetse chemie met veel ballast en omwegen, en met immense hoeveelheden afval. Dat levert nog geen grote problemen op, want de nieuwe medicijnen zijn zó krachtig dat zij vaak al werken in doseringen van één of enkele milligrammen. De totale wereldbehoefte is soms niet meer dan enkele tonnen. Dat maakt de afvalproductie beheersbaar, al is die nog steeds een blamage voor de chemische vaklui. Misschien, als het medicijn een wereldsucces wordt, komt er nog eens de kans om een prachtig geïntegreerd proces te ontwikkelen met behulp van slimme katalyse in geschakelde reactoren. Maar dan is er altijd nog de FDA of een andere machtige toezichthouder die elke verandering in productie of samenstelling van een medicijn tot een hachelijk avontuur maakt.
 De biologische cel: geschakelde biokatalyse
De biologische cel: geschakelde biokatalyse
Wij krijgen nieuw zicht op dit vraagstuk als we de biologische cel gaan beschouwen als minireactor. De DNA-machinerie zorgt ervoor dat de cel in leven blijft, zich desgewenst kan vermenigvuldigen tot nog meer reactortjes en dat alle onderdelen bijtijds vervangen of gerepareerd worden. Dat DNA zorgt ook voor de aanmaak van de enzymen die ervoor zorgen dat het (natuur)product waarin we geïnteresseerd zijn wordt aangemaakt. Biokatalyse is hier werkzaam in een hele reeks enzymen die samen de weg (het metabole pad) aangeven tot het uiteindelijke product. De moderne biotechnologie slaagt er steeds beter in om in te grijpen in de DNA-machinerie: genetische manipulatie. Bijvoorbeeld door de genetische codes voor het antimalariamiddel artemisinine over te brengen van de plant naar de E.Coli darmbacterie en dit organisme vervolgens flinke hoeveelheden van dit kostbare medicijn te laten produceren. Dit is een voorbeeld van verbeteren van de natuur (het bijvoetplantje dat artemisinine inefficiënt aanmaakt) met behulp van de natuur (het micro-organisme dat we kunnen africhten). Deze ontwikkelingsweg heeft vanuit industrieel oogpunt het grote voordeel dat de grootschalige productiemethode van de lead moleculen al in het lab is voorgedaan en ontwikkeld (wat veel tijdwinst geeft). De biologische cel treedt op als reactor, met al haar enzymen in de juiste volgorde en op de juiste plek. Dit is in principe ook de weg naar een duurzame productie op grote schaal. We kunnen immers zo veel biologische cellen kweken, fermentatie, als we maar willen.
 Maar het gebruik van de biologische cel als reactor heeft één nadeel. Weliswaar heeft de cel alles in huis wat we graag zouden willen – hij kan vele stappen in één proces uitvoeren – maar hij heeft de beperking dat je langs die weg eigenlijk alleen maar natuurlijke of semi-natuurlijke producten kunt maken. Want voor elke reactiestap in het metabole pad moeten biotechnologen de genetische codes daarvoor vinden in een of ander organisme. Dat gaat gemakkelijker naarmate de te ontwikkelen geneesmiddelen in hun moleculaire structuur dichter bij bekende natuurproducten staan. Naarmate de afstand tot natuurlijke structuren groter wordt, en dat is bij veel moderne kandidaat-medicijnen het geval, zal de bruikbaarheid van deze weg verminderen.
Maar het gebruik van de biologische cel als reactor heeft één nadeel. Weliswaar heeft de cel alles in huis wat we graag zouden willen – hij kan vele stappen in één proces uitvoeren – maar hij heeft de beperking dat je langs die weg eigenlijk alleen maar natuurlijke of semi-natuurlijke producten kunt maken. Want voor elke reactiestap in het metabole pad moeten biotechnologen de genetische codes daarvoor vinden in een of ander organisme. Dat gaat gemakkelijker naarmate de te ontwikkelen geneesmiddelen in hun moleculaire structuur dichter bij bekende natuurproducten staan. Naarmate de afstand tot natuurlijke structuren groter wordt, en dat is bij veel moderne kandidaat-medicijnen het geval, zal de bruikbaarheid van deze weg verminderen.
Synthetische biologie als sluitstuk voor de meer duurzame geneesmiddelenproductie
Maar de synthetische biologie kan hier te hulp komen en het bereik een stuk groter maken. De synthetische biologie maakt genetische informatie die nergens in de natuur voorkomt, maar die aan het menselijk brein is ontsproten en in het lab in elkaar is gezet. Eenmaal in een geschikt (micro)organisme ingebouwd kan het dat organisme aanzetten tot de productie van niet-natuurlijke of semi-natuurlijke producten met biokatalyse. Als deze nieuwe moleculen een medicinale werking blijken te hebben, staat de fabriek als het ware al gereed. Dit is een veelbelovend terrein; want weliswaar is het veld van natuurlijke geneesmiddelen behoorlijk afgestroopt, maar langs deze weg wordt het arsenaal sterk verbreed. De kans is groot dat wij zo toch voldoende semi-natuurlijke geneesmiddelen gaan vinden die via fermentatie gemaakt kunnen worden in een biologische cel. Zodat de integratie van reactor en katalysator alsnog kan plaats vinden: de rechter S-curve in ons diagram.
Als de farmaceutische industrie wil blijven vasthouden aan haar zeer ingewikkelde chemofarmaca, zal deze weg weinig perspectief bieden en de duurzame geneesmiddelenproductie zal niet van de grond komen. Maar als zij haar blik zou richten op het grote veld van semi-natuurlijke geneesmiddelen die wij met behulp van synthetische biologie kunnen maken, dan zou dit een fraai toekomstperspectief zijn. Het zou het einde van de fijnchemie voor medicijnen inluiden, maar wel de basis leggen voor een meer duurzame geneesmiddelenproductie.
(1) Concepts of Nature in Organic Synthesis: Cascade Catalysis and Multistep Conversions in Concert, Alle Bruggink, Rob Schoevaart, and Tom Kieboom, Organic Process Research & Development 2003, 7, 622-640.
