Men heeft vaak opgemerkt dat ontdekking en ontwikkeling van antibiotica uniek zijn. Dat geldt zowel voor de sulfa’s, als voor de penicillines en cefalosporines. De omstandigheden waaronder alles heeft plaats gevonden en het grote aantal toevalligheden kennen hun weerga niet. Toch moeten we nog een belangrijke ontdekking vermelde: streptomycine. Uit een onverwachte bron: een bacterie.
Project ‘100 jaar antibiotica’
Aflevering 29. De Gist; van illegaal naar wereldspeler
Aflevering 30. Cefalosporines
Aflevering 31. Hulp uit onverwachte hoek
Aflevering 32. Keerpunt 1950
Aflevering 33. De glorietijd 1960-1980
Wereldwijde zoektocht, strepto-mycine
In de jaren ’40 en ’50 zijn de penicillines enorm succesvol; de cefalosporines dragen grote beloften in zich. Het zijn beide medicijnen uit micro-organismen. Er komt een wereldwijde zoektocht naar meer voorbeelden op gang. Het Amerikaanse leger vindt een aantal zeer bruikbare micro-organismen. Albert Schatz, promovendus bij Selman Waksman aan de Rutgers universiteit, vindt een bacterie in een grondmonster van een zwaar bemeste akker in New Jersey. Daaruit isoleert hij op 19 oktober 1943 het antibioticum streptomycine. Waksman is bang voor bacteriële besmetting en laat zijn promovendus nogal aan zijn lot over. Erger nog, wanneer Waksman voor deze ontdekking in 1952 een Nobelprijs krijgt, is hij Schatz min of meer vergeten.
Maar met streptomycine hebben we wel goud in handen. Zonder de ontdekking van penicilline en cefalosporine zou streptomycine alle voorpagina’s hebben gehaald. De eerste grammen streptomycine worden al begin 1944 door Merck (ook de financier van het onderzoek) geproduceerd. Zij zetten een deel van het penicillineteam over op de ontwikkeling van streptomycine.
Voedselvergiftiging
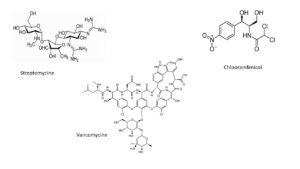
Streptomycine is het eerste antibioticum dat actief is tegen tuberculose, waarover zo dadelijk meer. Je kunt er ook de beruchte E.coli mee bestrijden. Net als de veroorzaker van de pest en longontsteking. Streptomycine bestrijdt ook voedselvergiftiging door Salmonella, urineweginfecties, ontstekingen aan het hart, brucellose (vergiftiging door rauwe zuivelproducten) en vele andere. Streptomycinestammen hebben ons meer dan tien prima antibiotica geleverd. Daaronder bekende namen als chlooramfenicol (1947), chloortetracycline (1948), neomycine (1949); ook vancomycine (1956) en de erythromycines (1952).
Chemici hebben de synthese van deze moleculen in het lab altijd als een grote uitdaging gezien. Het is inderdaad wel eens gelukt zo’n synthese uit te voeren, een enkele keer met een Nobelprijs als resultaat. Maar dat is nooit gevolgd door succesvolle productie op industriële schaal. Alle genoemde producten, met uitzondering van chlooramfenicol (maar dat is dan ook uitzonderlijk eenvoudig van structuur) maken we dus via biosynthese door kweek (fermentatie) van de betreffende micro-organismen. In sommige gevallen zijn de chemische structuren nauw verwant, zoals de amino-suikers in streptomycine en neomycine, later gevolgd met kanamycine (1957) en gentamycine (1963).
Opnieuw: toeval, serendipiteit of voorzienig-heid?
De enorme complexiteit van de structuurformules is verbazingwekkend; net als de grote diversiteit daarin. Zie bijvoorbeeld de formule van vancomycine. Veel auteurs noemen deze ingewikkelde producten een gift van de natuur. We weten nog heel veel niét. Waarom maken de microben zulke ingewikkelde en diverse structuren? Waarom gaat het opsporen ervan volledig via ‘trial and error’? De microben zijn gevonden op akkers in Venezuela, in het riool op Sardinië, in de mest van apen uit Japan, in de keel van een kip en op landerijen in Borneo, Indiana, Nebraska, Vermont, New Jersey, Virginia en New York. Dat Amerika zo vaak voorkomt is alleen maar doordat daar het meest gezocht is. Ook nu, 70 jaar later, hebben we op deze vragen nog geen, of op zijn best onvolledige antwoorden.
We weten tot op het atoom nauwkeurig hoe en waar het antibioticum de ziekmaker aanvalt. Van resistentie weten we ook bijna altijd het mechanisme te achterhalen. Toch is de ‘strategie’ van de bacterie om tot resistentie te komen nog vaak een grote vraag. Hoe komt de beruchte ziekenhuisbacterie Staphylococcus aureus (MRSA) erachter dat de vervanging van één stikstofatoom door een zuurstofatoom in de opbouw van zijn celwand voldoende is om de werking van vancomycine te saboteren? Voor de chemici: het aminozuur alanine in één van de lange ketenmoleculen van de celwand wordt vervangen door melkzuur. Hoeveel mutaties heeft de MRSA bacterie ‘geprobeerd’ om tot dit resultaat te komen? Bij de ontwikkeling van mutanten van het Covid virus zien we hier weer griezelige voorbeelden van. Een minstens zo grote vraag is: hoe lang heeft Streptomyces Orientalis (de schimmel die vancomycine levert) erover gedaan om tot deze enorm complexe chemische structuurformule te komen? Is deze stof het product van millenia evolutie, of was hij er nog maar pas toen hij op Borneo werd gevonden? En is het toeval dat op de akker in Indiana dezelfde schimmel is gevonden?
Genetische modificatie als genezer
Micro-organismen die antibiotica produceren hebben we vaak op alle mogelijke manieren aangepast, omwille van een zo goed mogelijke productie van het gewenste medicijn. Daarbij hebben onderzoekers vaak ingrijpende genetische modificaties aangebracht. Maar gelukkig heeft de ingewikkelde discussie over de voor en tegens van genetische modificatie de productie van (levensreddende) medicijnen nooit geraakt.
Deze genetische ingrepen zijn al begonnen met de penicillineschimmel. De penicillineschimmel in de fabrieken van nu heeft nog maar weinig overeenkomst met zijn natuurlijke voorouders. En met chemie hebben we heel succesvol kleine veranderingen kunnen aanbrengen in het product van het micro-organisme, al bij de penicillines en cefalosporines. Daarmee hebben we afgeleide medicijnen gemaakt met betere werking of minder bijwerkingen.
Ook tbc is aan de beurt
De tuberkelbacil is lang buiten schot gebleven. Ondanks alle prachtige resultaten van sulfa’s, pen’s en cef’s. Uiteindelijk is bestrijding van deze bacil gelukt met behulp van streptomycine. De werking van streptomycine is volstrekt anders dan die van penicillines. De stof grijpt aan op de genetische codes van de te bestrijden infectieveroorzaker en verhindert daarmee de aanmaak van essentiële eiwitten.
Geredeneerd met de kennis achteraf zijn met betrekking tot de tuberculosebacterie twee zaken van belang. Of misschien eigenlijk maar één: de aard van het beestje. De bacterie is erg klein, groeit langzaam en kan zich lang verborgen houden. Hij heeft bovendien een laagje was aan de buitenkant waardoor het voor veel medicijnen lastig is zich eraan te hechten. Een snelle reactie op toegediende medicijnen blijft hierdoor vaak uit. Het tweede punt is dat groots opgezette en langer durende proefprogramma’s niet gebruikelijk waren tot ca. 1950. Tot dan was de observatie van de arts de meetlat voor medicinale werking. En dat betrof eigenlijk altijd individuele gevallen of hooguit kleine groepen. De prachtige werking van de combinatie streptomycine/aminosalicylzuur op de tuberculosebacil kwam aan het licht met modern en langdurig onderzoek aan grote groepen patiënten. Met gebruik van statistiek in de duiding van de resultaten.
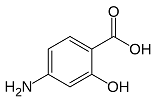
Net als de sulfa’s
Bij de formule voor aminosalicylzuur zal zelfs de niet-chemicus denken aan de plaatjes van de sulfa’s. En niet helemaal onterecht, want de stof speelt in zijn werking een soortgelijke rol als de sulfa’s. Hij verhindert namelijk de inbouw van p-aminobenzoëzuur bij de vorming van foliumzuur. De combinatietherapie met streptomycine/aminosalicylzuur voor de behandeling van tb bleef succesvol tot in de jaren ’80, toen tb ineens veel voorkwam in combinatie met AIDS. Inmiddels wordt de bestrijding van tb ernstig geplaagd door resistente bacterievarianten. Daardoor behoort de sterfte aan tb nog tot de top tien doodsoorzaken; ongeveer evenveel mensen sterven aan tb als bij verkeersongelukken.
Geraadpleegde bronnen:
Wikipedia: alle genoemde eigennamen en producten
Antibiotics: from prehistory to the present day, Kate Gould, Journal of Antimicrobial Chemotherapy 71, 572-575(2016)
N0-nonsense Guide to Antibiotics, Moira Dolan, SmartMedInfo, 2015; ISBN: 978-09968860-2-4
