Schimmels zijn de producenten van onze allerbelangrijkste antibiotica. Maar ze kunnen ons ook tot last of zelfs gevaar zijn. We gaan het niet hebben over de relatief onschuldige en goed te behandelen aandoeningen, veelal aan of bij de buitenkant van ons lichaam. We beperken ons tot de zogeheten systemische schimmelinfecties die in ons lichaam belangrijke organen zoals hart, hersenen of longen kunnen aantasten. De parallellen met de bestrijding van bacteriële infecties zijn treffend en illustratief. Hier, zoals daar, een langzame ontwikkeling. En ook hier medicijnen die op de plank blijven liggen.
Project ‘100 jaar antibiotica’
Aflevering 62. Kruidengeneeskunde
Aflevering 63. Moderne vaccins
Aflevering 64. Schimmelinfecties
Aflevering 65. Grenzen aan de maakbaarheid
Aflevering 66. De evolutionaire wapenwedloop
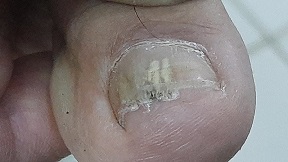
Drie groepen schimmel-infecties
We kennen de schimmelinfecties aan onze buitenkant en in onze lichaamsopeningen maar al te goed. Denk aan voetschimmel / zwemmerseczeem, kalknagels, ringworm en candida infecties in de mond of de vagina. Deze vormen zijn zelden of nooit levensbedreigend, en goed te behandelen met een keur aan middelen. Maar toch, wereldwijd wordt het aantal dodelijke slachtoffers van alle schimmelinfecties samen geschat op 1,7 miljoen in 2020. De infecties in ons lichaam, de systemische infecties, zijn het meest gevaarlijk. Ze komen bij het grootste deel van de bevolking nauwelijks voor, maar zijn een gevaar voor mensen met een verzwakt immuunsysteem.
De meeste schimmels komen als sporen via de longen naar binnen. Dat gebeurt bij HIV patiënten, gebruikers van immuunonderdrukkers na een orgaantransplantatie, gebruikers van antikanker middelen en verzwakte ouderen. Vooral bij het steeds ouder worden gaat een ziekte vaak hand in hand met ernstige schimmelinfecties; behandeling is vaak erg lastig. Van de genoemde 1,7 miljoen slachtoffers behoort meer dan 1 miljoen tot personen met een verzwakte afweer. En dan is de kans op overlijden groot: tot wel 50%. In combinatie met Covid besmetting en/of antibioticagebruik is de kans op schimmelinfectie ook groter. Vooral in India komt de combinatie Covid/zwarte schimmel veel voor.
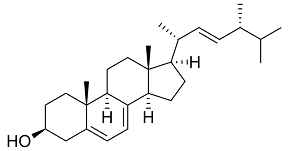
Medicijnen en werking
We kennen vier groepen antischimmelmedicijnen; hun werkingsmechanismes lijken sterk op die van antibiotica. De eerste groep medicijnen, zoals amfotericine b, zijn op de markt sinds de jaren ‘50. Amfotericine is een natuurproduct, een loot aan de stam van de grote streptomycine familie die ons ook veel antibiotica heeft geleverd. Onderzoekers deden de ontdekking in de Orinoco rivier in Venezuela. Het bindt aan ergosterol, een steroïde dat in micro-organismen dezelfde functie heeft als cholesterol bij mens en dier. Het laat gaten vallen in de celwand van de schimmel. In medische zin is het onderscheid tussen ergosterol en cholesterol niet erg groot; er zijn daardoor ernstige bijwerkingen, vooral niervergiftiging.
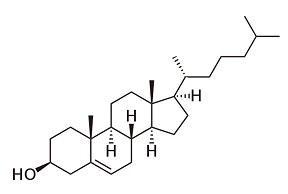
De meest bekende en meest toegepaste groep medicijnen zijn de azolen; de enige die ook als pilletje kunnen worden ingenomen. De azolen zijn geheel synthetische producten. De eerste, ketoconazool, is sinds 1980 op de markt. Andere bekende namen zijn fluconazool en miconazool. Ze voorkomen de aanmaak van ergosterol door een enzym daarvoor te blokkeren. Helaas zijn dat enzymen die ook bij de mens voorkomen, met als gevolg giftigheid voor de lever als ernstige bijwerking. Resistentie is uiteraard ook hier een probleem; vooral bij de azolen. Deze middelen leggen de schimmel stil, maar doden die niet en geven op die manier extra kansen aan een vorm die resistent is. Het veelvuldig gebruik van azolen in landbouwchemicaliën, zoals op de tulpenbollen, is ook niet bevorderlijk. We kennen daardoor al een aantal generaties azolen en meer dan 25 verschillende productnamen. Daarnaast kennen we middelen die de genetische code van de schimmel of de sporen ervan in de war sturen. Flucytosine is hiervan de meest bekende.
Industriële ontwikkeling
De belangstelling van de industrie voor de ontwikkeling van betere producten is erg laag; net als bij antibiotica, en om dezelfde redenen. Het nieuwste middel dateert uit 2001; het behoort tot de groep van de echinocandines. Deze middelen blokkeren enzymen die essentieel zijn in de aanmaak van bouwstenen voor de celwand. Ze worden dan ook wel de penicillines van de schimmelbestrijding genoemd. Deze keer gaat het om suikerachtige producten. De echinocandines horen bij de grote groep van de antimicrobiële peptiden (zie aflevering 54, Als chemie en biotech samen optrekken); voor deze toepassing zijn ze voorzien van een lange koolstofketen van vetzuren. Een aantal nieuwe vertegenwoordigers van deze groep is momenteel in klinisch onderzoek.
Zoektocht naar nieuwe producten, ethische problemen
Bij de antibiotica zijn de zorgen om besmetting door resistente bacteriën de grootste drijfveer voor onderzoek naar nieuwe middelen. Bij schimmelinfecties speelt dit ook een rol. Maar ook de opkomst van onbehandelbare nieuwe schimmels, zoals de gist Candida auris, is een drijfveer. Vooral in de VS richt het onderzoek zich op (zeer) oude, zieke patiënten, die met een verzwakt immuunsysteem in het ziekenhuis liggen. Een schimmelinfectie is dan vaak de oorzaak van de (iets eerdere) dood.
Een schimmel heeft in zijn cellulaire opbouw meer overeenkomsten met mens en dier dan bijvoorbeeld een bacterie. Dit verklaart de ernstige bijwerkingen zoals hierboven genoemd. De zoektocht naar nieuwe middelen moet zich dus vooral richten op een essentieel onderdeel van de schimmel met een structuur die in mens of dier niet voorkomt. Eén van de kandidaten is een eiwit met een groot aantal suikers (mannose) aan de buitenkant. Het complex is onderdeel van de celwand van de schimmel (menselijke cellen hebben geen stevige celwand, maar een veel dunner membraan om de boel bijeen te houden). Schimmels hebben het betreffende eiwit nodig om een menselijke cel binnen te komen en besmetting te veroorzaken. Het moet voortdurend vervangen worden om de schimmel virulent te houden en te beschermen tegen aanpak door ons immuunsysteem. Het belemmeren van de aanmaak hiervan zou dus een goede zaak zijn.
Een moeilijke zoektocht
Het enzym dat ervoor zorgt dat het suiker/eiwit complex aan de celwand wordt bevestigd is goed bekend en een prima doel om te blokkeren. Helaas is het enzym erg groot en heel lastig als kristal te isoleren. Enzymen waarvan de kristalstructuur bekend is kunnen we op het computerscherm onderzoeken. Bijvoorbeeld op mogelijkheden om het te blokkeren op de gevoeligste plekken, met bestaande geneesmiddelen of andere moleculen. Maar in dit geval was heel veel klassiek labwerk nodig. De Japanse firma Esai heeft meer dan 10 jaar gezocht en uiteindelijk het product Fosmanogepix ontwikkeld. Het middel belemmert inderdaad de verankering van het eiwit/suiker complex aan de celwand; bovendien hoopt dat complex zich op in de schimmelcel en verstoort daardoor allerlei andere functies. Dierproeven laten zien dat dierlijke cellen niet worden aangepakt. Het middel is nu in klinisch onderzoek.
Het blokkeren van belangrijke enzymen in een besmettend organisme is duidelijk een populaire lijn van onderzoek. Een enzym dat een rol speelt bij de aanmaak van pyrimidine, een onderdeel van de genetische code, is deze keer het doel. Na 340.000 pogingen met een keur aan moleculen lukt het de firma F2G een molecuul te vinden dat voldoende specifiek is. Het belemmert de aanmaak van pyrimidine 2.200 maal beter dan bij menselijke cellen. Hoe het middel te werk gaat is zelfs onder de microscoop te volgen: de schimmelcel stopt met groeien, zwelt op en barst uit elkaar. Het is als een pilletje in te nemen, zelfs preventief; bijvoorbeeld bij patiënten met een verzwakte afweer.
Schimmelinfecties bij oudere patiënten
Het organiseren van een modern dubbelblind klinisch onderzoek is voor systemische schimmelinfecties uitermate lastig. Het gaat altijd om zieke en (zeer) oude mensen of patiënten met een behoorlijk verzwakte afweer. Vooral in de VS richt het onderzoek zich op ernstig zieke oude mensen. Het is dan lastig, de onderliggende ziekte en de schimmelinfectie uit elkaar te halen. En het rekruteren van voldoende patiënten voor een groot groepsonderzoek is bijna onbegonnen werk. Tijdens het onderzoek, dat een flink aantal weken duurt, sterven veel van de patiënten; maar waaraan? Bovendien: behandelend artsen wachten vaak niet op een nieuw (veelbelovend?) middel en beginnen al met een bekend middel tegen schimmels. Lastig om dan het effect van een nieuw middel te meten.
Het kost bovendien drie dagen om een schimmel uit het bloed van een patiënt op te kweken en te identificeren. Veel patiënten zijn dan al overleden. En, ook niet onbelangrijk, wie kan er geld mee verdienen? Ook bij antibiotica kwamen we dit probleem al tegen; nieuwe middelen houdt men het liefst op reserve. Dan is de doelgroep ook nog eens klein; deze mensen hebben niet lang meer te leven, dus voor de industrie zal er weinig omzet zijn. Sommigen hopen dat de Covid 19 pandemie meer aandacht voor onderzoek naar bestrijding van schimmelinfecties zal brengen.
Doorgeschoten?
Bij de Covid pandemie zijn er geluiden dat het ‘gezond’ zou zijn voor de mensheid dat vooral oudere, verzwakte mensen het slachtoffer worden. Een nogal onethische zienswijze. Maar ook bij het onderzoek aan het voorkómen of behandelen van schimmelinfecties bij (zeer) oude en ernstig zieke mensen komt de vraag bovendrijven: ‘waarvoor doen we het’? Vooral in de VS is het verlengen van een aflopend leven met enkele weken of maanden een verdienmodel geworden; meer dan daadwerkelijke hulp aan zieke en zwakke bejaarden. De gezondheidswinst is vaak minimaal, zeker als die wordt uitgedrukt in gewonnen gezonde extra levensjaren. Het is al lang bekend dat veel geld dat nu naar Alzheimeronderzoek gaat, nuttiger besteed kan worden. Vooral aan een betere bereikbaarheid van alle al bestaande medicijnen, in al die achtergestelde gebieden van deze planeet; de gezondheidswinst daarvan zou tientallen malen groter zijn dan de effecten van een middel tegen dementie. Maar we zijn toch rijk genoeg om beide te doen?!
Geraadpleegde bronnen:
Wikipedia: alle genoemde eigennamen en producten
The fight against fungi (acs.org) C&N News maart 2021
Entangled Life: How Fungi Make Our Worlds, Change Our Minds, and Shape Our Futures — Merlin Sheldrake, 2020.
