Virussen als medicijn staan pas sinds kort in de belangstelling. Het gaat in het bijzonder om bacteriofagen (kortweg: fagen), virussen die bacteriën eten. Dat er zulke fagen bestaan is nog niet zo lang, minder dan een eeuw, bekend. Vanwege die bacterie-etende eigenschap kunnen fagen als medicijn worden gebruikt. Als alternatief voor, of als aanvulling op antibiotica. Maar door het vroege succes van antibiotica werden ze lang niet serieus genomen. Pas sinds resistentie tegen antibiotica een serieus probleem wordt, is er hernieuwde belangstelling voor bacteriofagen. En nu is er dus een Nederlandstalig overzichtswerk.
Een eeuwigdurende strijd
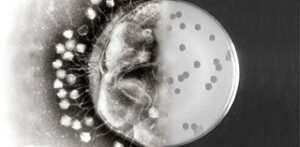
Fagen zijn al eeuwen lang verwikkeld in een strijd met bacteriën. Vermoedelijk al twee miljard jaar. Maar fagen zijn zeer specifiek. Elke bacteriesoort heeft zijn eigen faag (of fagen). De meest voorkomende bacteriofagen zijn lytische fagen. Deze doden de gevoelige bacterie vrijwel meteen. De faag injecteert zijn genetische materiaal in de bacterie. Dit zet de bacterie aan tot het produceren van veel nieuwe fagen. Dan breekt de celwand open en komen de fagen vrij. Deze infecteren direct weer nieuwe bacteriën. Maar dus alleen bacteriën waartegen déze faag werkzaam is.
Fagen herkennen een receptor op de bacterie. Receptoren zijn zeer specifiek en zelfs niet hetzelfde voor alle verder gelijke bacteriën. Daarom moeten we bij bestrijding van een bacteriële infectie precies de faag vinden die de receptor van de bacterie herkent. In tegenstelling tot een antibioticakuur is een fagenkuur daardoor heel doelgericht en individueel. Bovendien kan het binnendringen van bacteriofagen mutaties veroorzaken in de bacterie, waardoor resistentie tegen deze specifieke faag ontstaat. Een mechanisme dat bij faagbehandelingen geregeld wordt geconstateerd.
Resistentie tegen bacteriofagen
Soms worden bacteriën al binnen een paar uur resistent tegen een bepaalde faag. Maar we hebben één geluk: ook de fagen passen zich razendsnel aan. Kortom, fagen en bacteriën zijn al zo lang ze bestaan, betrokken bij een evolutionair proces dat wij niet kunnen vermijden. Het proces van aanvallen van de betreffende bacterie, het ontwikkelen van resistentie, en aanpassing van de faag aan de nieuwe situatie, leidt ertoe dat bacteriën vaak worden bestreden met faagcocktails. Hetzij cocktails met verschillende fagen die werken tegen dezelfde bacterie, hetzij cocktails die werken tegen verschillende bacteriën. Maar dit betekent wel dat wij onze bestrijding van bacteriën voortdurend moeten aanpassen – net zoals de fagen zich aanpassen aan onze bestrijdingsmiddelen. De steen der wijzen in dit proces zou de ontdekking van een mechanisme zijn waarmee bacteriën resistentie ontwikkelen – maar voorlopig zijn we daar nog ver van verwijderd.
Eén manier om de ontwikkeling van resistentie bij bacteriën te omzeilen is het gelijktijdig toedienen van antibiotica en fagen. Of het geven van een bredere activiteit aan fagen, waardoor zij het verdedigingsmechanisme van de bacterie kunnen omzeilen. Een andere techniek bestaat uit het toedienen van fagen één voor één. Stel dat de fagen nog 1% van de bacteriën in leven laten, dan kan het achtereenvolgens toedienen van fagen al een groot verschil maken. Maar ook hier geldt: uiteindelijk zal de strijd tussen bacterie en bacteriofaag niet worden beslist – de natuur vindt steeds weer een weg achter de faag om. Al kan de bacterie wel verzwakt uit deze strijd komen, wat weer ruimte geeft aan antibiotica om de strijd te beslechten.
Specifieke behandelingen
De studie van bacteriofagen was lang een activiteit van achter het ‘ijzeren gordijn’, de scheidsmuur die in Europa was opgetrokken tussen de landen van de NAVO en het Warschaupact. In de Westerse wereld waren fagen vrijwel onbekend geworden. De kennis ervan was terecht gekomen in Georgië, een uithoek van de Sovjet-Unie; terwijl in het Westen de kennis van antibiotica bloeide.
Maar zoals gezegd, antibiotica bleken geen universele wondermiddelen. Er ontstond steeds meer resistentie tegen, soms al snel na hun introductie. Uiteindelijk leidde dit tot hernieuwde belangstelling voor fagen. Al komen deze met hun eigen problemen. Want in tegenstelling tot antibiotica zijn fagen zeer specifiek. Er zijn geen ‘breedspectrum’ fagen. Bij elke besmetting moet een specifieke faag worden gezocht. Dus hoewel Van den Brink een heel hoofdstuk wijdt aan ‘spectaculaire voorbeelden van geslaagde behandelingen met bacteriofagen’, is het elke keer weer spannend of de juiste faag wordt gevonden die tegen déze besmetting actief is.
Overal, maar specifiek
Overal waar bacteriën zijn, zijn ook fagen. Aan het eind van de negentiende eeuw ontdekten onderzoekers dat bacteriën gedood konden worden – door iets dat op dat moment onbekend was. Twintig jaar later ontdekte D’Hérelle dat ‘bacteriofagen’ de bacteriën opruimden. En daarna duurde het nog twintig jaar voordat men de fagen ook echt kon zien, met een elektronenmicroscoop.
Bacteriofagen zijn heel specifiek en daardoor moeilijk te gebruiken. Ze moeten eerst worden ontdekt. Maar juist dat specifieke karakter maakt ook dat ze heel effectief zijn. Een door een faag geïnfecteerde bacterie spat na zo’n twintig minuten uit elkaar, waarbij er tientallen tot honderden nieuwe fagen vrijkomen. Binnen een paar uur ontstaat zo een enorme hoeveelheid fagen, waartegen de bacterie het loodje legt. Het is gunstig dat antibioticaresistentie los staat van resistentie tegen fagen. Daardoor kunnen ook ‘moeilijke’ infecties altijd nog met fagen worden bestreden – als men de juiste faag weet te vinden.
Behoefte aan een flexibele richtlijn
Maar er is een probleem. Noch antibiotica, noch fagen doden alle ziekteverwekkende bacteriën. Misschien doen ze dat in combinatie wel. Maar we hebben voor lang niet alle ziekten de juiste faag bij de hand. We weten bovendien niet hoe lang fagen hun activiteit behouden. We weten niet eens hoe bacteriofagen het beste kunnen worden toegediend aan een patiënt.
Bovendien zijn de bestaande richtlijnen voor toelating van faagproducten niet toegesneden op fagen. Het Europees Geneesmiddelenbureau EMA heeft een richtlijn vastgesteld waaraan bacteriofagen moeten voldoen om toegelaten te worden. Maar er is nog geen product dat daaraan voldoet. Bovendien veranderen bacteriën vaak onder invloed van een faag, waardoor ze resistent worden. De faag moet daarop zelf ook veranderen. Dat doet deze vrij snel – maar aanpassing van de richtlijn met dezelfde snelheid is niet goed mogelijk. Er is dus volgens onderzoekers een flexibele oplossing nodig die snel kan worden aangepast; maar deze bureaucratische puzzel is tot nu toe niet opgelost. Misschien zal toenemende antibioticaresistentie een prikkel gaan vormen om een oplossing voor dit vraagstuk te vinden.
Gereedschapskist van artsen
De laatste jaren zijn gelukkig publicaties verschenen met succesvolle faagtherapieën. Daardoor komen deze uit de hoek van specialistische behandelingen. Financiering kan nog wel een probleem vormen – elke Europese staat heeft daarvoor weer andere oplossingen. En toch bestaat op dit gebied een grote behoefte. Resistentie tegen antibiotica neemt veel sneller toe dan de ontwikkeling van nieuwe therapieën. Het ziet er daarom naar uit dat bacteriofagen een plaats zullen krijgen in de gereedschapskist van artsen. Ze werken bijvoorbeeld heel goed tegen infecties van kunstmaterialen als kunstheupen. Daarop vormen zich vaak biofilms, die na een tijdje niet meer met antibiotica bestreden kunnen worden. Fagen kunnen hierbij de antibiotica ondersteunen, door de biofilm af te breken.
Hoewel faagbehandelingen vaak succesvol zijn, komt het ook geregeld voor dat zo’n behandeling niet aanslaat. Vaak is het onvoorspelbaar bij wie zo’n therapie wel of niet aanslaat. Daarom zetten sommige onderzoekers zich in voor een internationale databank waarin alle ervaringen met fagen worden opgenomen.
Lysines
Lysines zijn ‘een verbeterde versie van de enzymen die bacteriofagen produceren om bacteriën open te breken en te doden. Dankzij hun specifieke heel gerichte werking doden de lysines alleen de bacterie waartegen ze gericht zijn, en laten de rest van de flora ongemoeid.’ Er zijn ook synthetische lysines, potentieel ideale antibacteriële precisiemiddelen, te maken tegen ‘in principe tegen vrijwel alle bacteriën’ (p.237).
Lysines kunnen het gebruik verminderen van breedspectrumantibiotica; middelen waarvan de nadelen steeds meer duidelijk worden. Ze verstoren de balans in onze darmen en worden in verband gebracht met ziekten als parkinson, alzheimer en multiple sclerose. Lysines zijn vriendelijker voor het microbioom. Lysines en bacteriofagen zijn ‘in zekere zin complementair aan elkaar. Lysines zijn eerder geschikt om acute infecties te behandelen, fagen juist voor chronische infecties. Lysines vormen daardoor een fraai complement op fagen. Al zullen ook lysines nog goedgekeurd moeten worden als geneesmiddel.
Naar precisiegeneeskunde
Behandeling van bacteriële infecties zal steeds meer een zaak worden van precies ingrijpen. Middelen zullen heel specifiek gericht worden op die éne bacterie. Precisie-antibiotica als lysines zullen behandelingen sterk veranderen. Met aangepaste lysines zullen wij in de toekomst misschien heel precies ook ‘moeilijke’ bacteriën kunnen aanpakken. Ook faagtherapie, nu nog niet helemaal volwassen, kan gaan zorgen voor revolutionaire veranderingen.
Bacteriofagen, zo besluit Van den Brink zijn boek, gaan ‘zeer waarschijnlijk de komende tijd een steeds belangrijker rol spelen’ (p.256). Maar hij komt wel direct met een waarschuwing. Regelgeving loopt nog achter bij de ontdekkingen rond fagen. Daar wordt aan gewerkt. Internationaal is er steeds meer belangstelling voor fagen op congressen. Ook de WHO heeft zich op het onderwerp gestort. ‘Het heeft er alle schijn van dat bacteriofagen aan een opmars begonnen zijn die deze keer onomkeerbaar lijkt.’
Interessant? Lees dan ook:
Bacteriofagen, hulp in nood
Chemie versus bacterie. Bacteriofagen: bijna vergeten, maar….
Chemie versus bacterie. Faagtherapie, een veelbelovend alternatief voor antibiotica?
